清华AI找药登Science:日筛十万亿次,破解AlphaFold最后一公里
type
status
date
slug
summary
tags
category
icon
password
网址
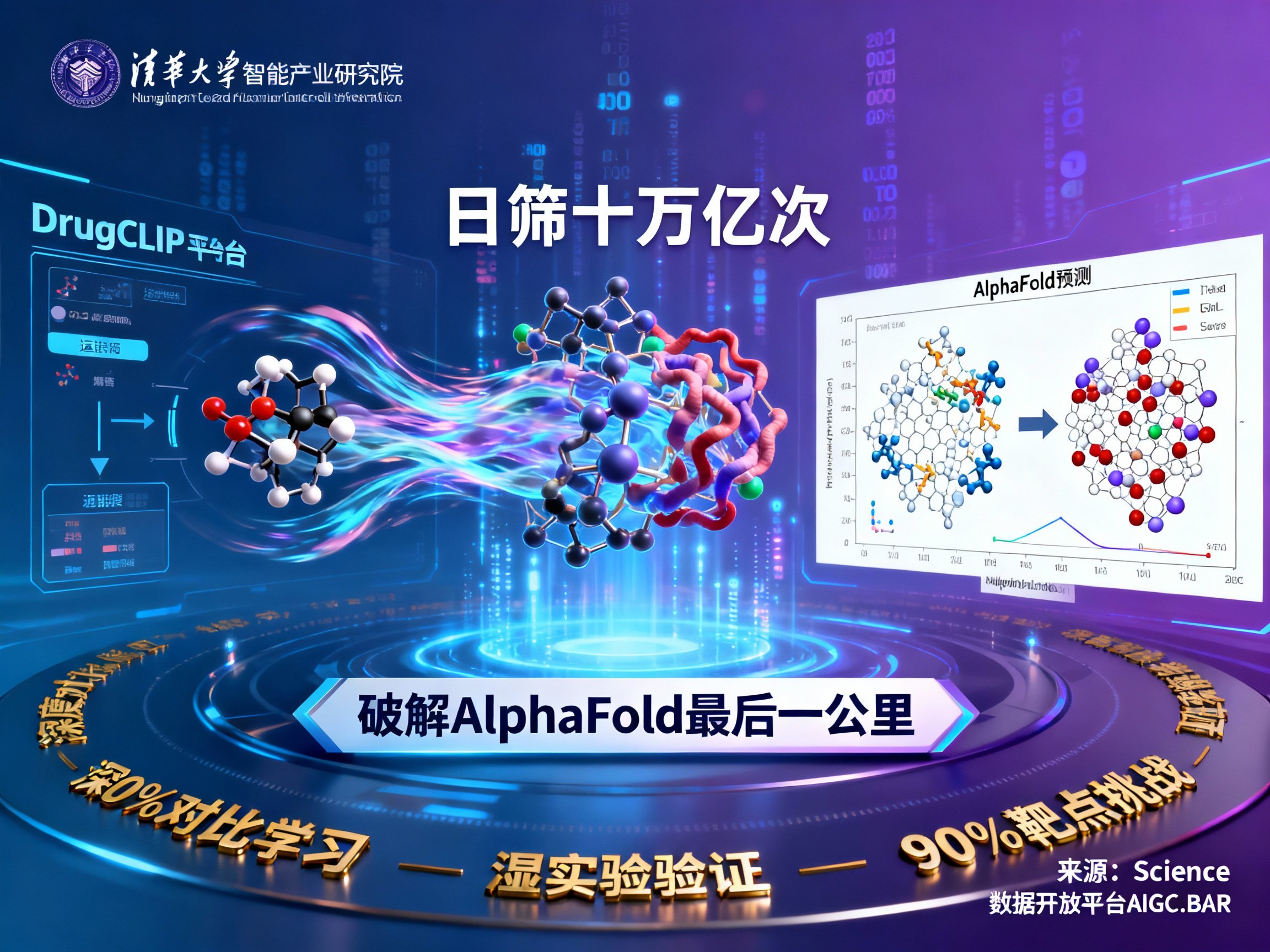
在人工智能重塑科学发现的浪潮中,中国科研团队再次取得了里程碑式的突破。近日,清华大学智能产业研究院(AIR)联合生命学院及化学系团队,在国际顶级学术期刊《Science》上发表了题为《深度对比学习实现基因组级别药物虚拟筛选》的重磅论文。这项研究不仅展示了AI在生物医药领域的巨大潜力,更通过研发名为DrugCLIP的AI驱动平台,解决了从AlphaFold蛋白质结构预测到实际药物发现之间的“最后一公里”难题。
对于关注人工智能(AI)和AGI发展的读者来说,这是一个激动人心的时刻。DrugCLIP平台展现了惊人的算力与效率——在24小时内完成10万亿次蛋白-分子配对计算。这一突破不仅大幅缩短了新药研发的周期,更为抑郁症、癌症、帕金森等疑难杂症的治疗带来了全新的希望。如果你想了解更多关于此类前沿科技的AI资讯,欢迎访问 AIGC.BAR 获取最新动态。
破解“无药可救”的困局:90%靶点的挑战
长期以来,药物研发领域面临着一个严峻的现实:在人体约2万个编码蛋白质的基因中,虽然相当一部分与重大疾病密切相关,但目前真正拥有成熟药物的蛋白靶点仅占10%。剩下的90%被称为“不可成药”或“难成药”靶点。
造成这一困局的原因主要有三点:
1. 效率低下:传统的分子对接筛选方法如同大海捞针,需要逐一计算分子与蛋白的结合可能性。即便使用最先进的工具,面对海量数据时,计算成本也高得惊人。
2. 无从下手:许多关键蛋白缺乏实验测定的三维结构,且在真实世界中,无效分子的噪声极大,掩盖了潜在的有效药物分子。
3. 范围受限:受限于算力,传统研究往往只能围绕少数热门靶点进行,难以在全基因组尺度上展开探索。
清华团队的DrugCLIP正是为了打破这三大壁垒而生。它不再局限于传统的物理模拟,而是引入了大模型时代的深度学习技术,重新定义了药物筛选的范式。
DrugCLIP的核心逻辑:给分子与蛋白“画像”
DrugCLIP之所以能实现效率的百万倍提升,核心在于其独特的算法架构——深度对比学习。研究团队并没有让AI去死记硬背复杂的物理公式,而是训练了两个AI编码器,分别负责给“蛋白质结合口袋”和“化学分子”进行“画像”(生成特征向量)。
这一过程可以被通俗地理解为一种高级的“相亲匹配”系统:
* 特征提取:AI通过学习海量数据,掌握了蛋白质与分子结合的“神韵”。
* 对比学习:在训练中,AI被教导将能结合的配对(特征向量)拉近,将不能结合的推远。
* 预训练策略:团队创新性地利用现有数据构造了550万组“假分子”和“假口袋”样本进行预训练,随后用真实数据微调,极大地提升了模型的泛化能力。
当模型训练完成后,传统的物理对接问题被转化为高效的向量检索问题。面对一个新的蛋白口袋,AI只需生成其向量,然后在已存储的5亿个分子向量库中进行检索比对。这种机制使得DrugCLIP在单节点(128核CPU+8张GPU)上的日处理能力达到了惊人的10万亿次。
从理论到现实:湿实验验证的惊人成功
速度快固然重要,但准确率才是药物研发的生命线。DrugCLIP在多个标准虚拟筛选基准测试中表现优异,更重要的是,它在真实的生物实验室(湿实验)中证明了自己的价值。
- 抗抑郁药物新发现:在针对去甲肾上腺素转运体(NET)的筛选中,团队从160万个分子中选出约100个高分分子,实验显示其中15%为有效抑制剂,部分分子的效果甚至优于现有的临床药物安非他酮。
- 挑战无结构蛋白:针对与癌症和帕金森病相关的E3泛素连接酶TRIP12,这是一个既无实验结构也无已知抑制剂的“硬骨头”。团队利用AlphaFold2预测的结构进行筛选,成功找到了具有抑制活性的分子。
这些案例有力地证明,DrugCLIP不仅能处理已知靶点,更能有效利用AlphaFold预测的结构,真正打通了从AI预测结构到发现药物分子的关键路径。
构建人类基因组规模的“药物种子库”
DrugCLIP的野心不止于此。研究团队首次完成了覆盖人类基因组规模的虚拟筛选项目。这意味着他们针对约1万个蛋白靶点和2万个结合口袋,分析了超过5亿个小分子,最终富集出200多万个高潜力活性分子。
这一壮举相当于为人类近一半的蛋白质提前建立了一个庞大的“药物种子库”。无论是针对已知疾病的优化,还是面对未来可能出现的未知疾病,科学家们都可以从这个数据库中快速找到潜在的候选药物。
目前,相关数据已全面对外开放,这将极大地加速全球生命健康领域的科研进程。这种开源精神与OpenAI等机构推动技术普及的理念不谋而合,将推动整个行业向数据驱动的全新科研范式转型。
结语
清华大学团队在《Science》发表的这项成果,标志着AI制药从“概念验证”迈向了“工业级应用”的新阶段。DrugCLIP不仅解决了算力瓶颈,更通过与AlphaFold的无缝衔接,拓展了人类探索微观生命世界的边界。
随着大模型和LLM技术的不断演进,我们有理由相信,AI将在抗癌、传染病防治以及罕见病药物研发中发挥越来越关键的作用。对于希望紧跟人工智能前沿动态,了解更多关于AI如何改变医疗、科技与生活的读者,请持续关注专业AI新闻门户 AIGC.BAR,获取第一手的深度资讯与分析。
Loading...
.png?table=collection&id=1e16e373-c263-81c6-a9df-000bd9c77bef&t=1e16e373-c263-81c6-a9df-000bd9c77bef)